Servicios de Gestión de Datos
Insights rápidos y precisos

¡Únete a nuestro programa de Adopción
Temprana con un descuento de estudio inicial!
Únete haciendo click en el botón Aplicar Ahora
-
Permite la resolución temprana de problemas.
-
Envía notificaciones y alertas a los sities.
-
Garantice la calidad de los datos.
-
Reciba mejores resultados.
-
Te da velocidad y precisión.
-
Garantiza una mejor y más rápida toma de decisiones.
-
Incluye dos diccionarios (MeDRA y OMS) que brindan consejos sobre la terminología médica y de medicamentos estándar.
La gestión de datos a través de nuestro CRF aprovecha las verificaciones automáticas y las tareas automáticas para garantizar procesos rápidos y sin errores.
Nuestro CRF ya está integrado y sincronizado con nuestro PFS (Sistema de seguimiento de pacientes), utilizado por los sitios para administrar un ensayo clínico; reduciendo así errores y costos en la transferencia o digitalización de datos.
Experiencia en gestión de datos
-
Estudio de Polio Fase 2 - Colombia
-
Estudio de Polio Fase 2 - Panama, Dominican Republic
-
Control de natalidad con Real World Evidence (RWE) - Peru
-
Cáncer de mama (RWE) - Colombia
-
mCRPC (RWE) - Colombia
-
Estudio observacional de norovirus - Panama
-
Trastorno de la excitación sexual fase 3 - Colombia
-
Real World Evidence (RWE) Asma - Colombia, Argentina, Golfo Pérsico, India, Chile, Turquía, Arabia Saudita)
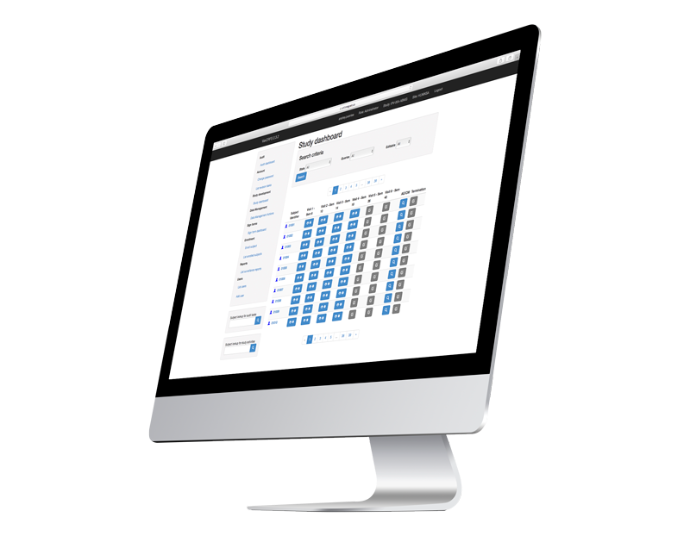

eCRF y
Experiencia en gestión de datos
Uso de nuestro eCRF y servicios:
-
Nuestro eCRF utiliza el estándar CDASH y permite la exportación de datos a un formato SAS para análisis estadístico. También disponible en Excel y CSV.
-
Fácil cumplimiento de CDISC gracias a la conversión estándar CDASH y SDTM según las necesidades del estudio.
Completados:
-
Estudio de Fase 2 de Polio - Colombia (Vax Trials - Bill & Melinda Gates Foundation) - 2014
-
Estudio de Fase 2 de Polio - Panamá, Republica Dominicana (Vax Trials, FIDEC) - 2017
En curso:
-
Control de natalidad con Real World Evidence (RWE) - Perú (JSS, Bayer) - 2020
-
Estudio observacional de norovirus - Panamá (Cevaxin, Takeda) - 2020
-
Cáncer de mama (RWE) - Colombia (JSS, Pfizer) - 2020
-
Cáncer de próstata (RWE) - Colombia (JSS, Bayer) - 2021
-
Trastorno de la excitación sexual fase 3 - Colombia (JSS, Litaphar) -2021

Desarrollamos software como servicio, mira como funcionan.
CONTÁCTANOS
Case Report Form System
CRF & Experiencia de Gestión de Datos
Nuestro eCRF es un sistema EDC WEB desarrollado para permitir a los usuarios ingresar, verificar y firmar información de ensayos clínicos, donde se habilitan las siguientes funcionalidades.
Aleatorizar Sujetos
Enrolar Sujetos
Ingresar Datos
Verificar Información
Gestionar consultas
Agregar Firmas Electrónicas (Pls)
Descargar Reportes
Las funcionalidades mencionadas pueden ser realizadas por los siguientes roles, dependiendo del acceso especificado para cada uno:
Entrada de Datos
CRA
Investigador Principal
Nuestro eCRF ya está integrado y sincronizado con nuestro PFS (Sistema de Seguimiento de Pacientes), utilizado por los sitios para administrar un ensayo clínico, reduciendo así errores y costos en la transferencia de datos o digitalización.
Paneles de control de funciones
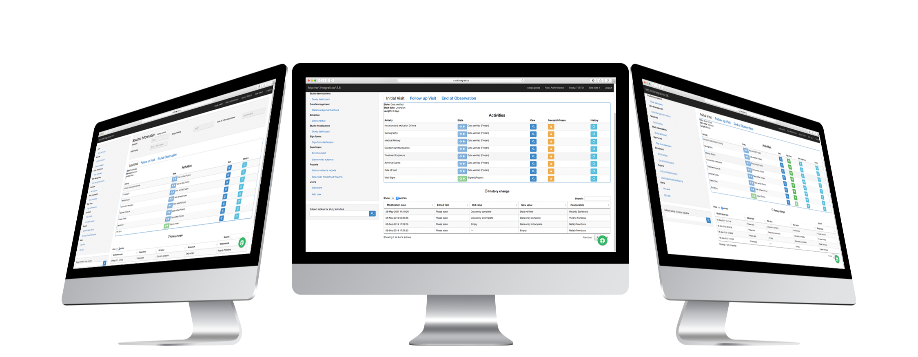
Rol de Entrada de Datos
La persona encargada de ingresar la información tendrá el rol de Data Entry. Este rol puede:
-
Aleatorizar Sujetos
-
Enrolar Sujetos
-
Ingresar Datos
Rol de CRA
La CRA es la persona encargada de verificar y gestionar las consultas. Este rol puede:
-
Verificar Información
-
Gestionar consultas
-
Descargar reportes
Investigador Principal
El investigador principal verifica la información y la firma para su aprobación. Este rol puede:
-
Agregar Fimectrónica (Pls)
-
Descargar Reportes
Una solución fácil de usar
Colores e Iconos
El estado de las visitas y observaciones se etiquetan con colores e iconos según la etapa de cada proceso y lo que le está sucediendo. Los colores e iconos se utilizan de la siguiente manera:
Página vacía / No info
Información no verificada
por el CRA
Consultas pendientes
Verificado por el CRA
Firmado por el PI

Si deseas saber más sobre cómo nuestros sistemas están validados y cumplen con 21 CFR Part 11
Reportes
Reportes de Vigilancia
Los investigadores y las CRA pueden generar los siguientes informes de vigilancia para ver cómo avanza el ensayo:
-
Informe de seguimiento general
-
Informe de seguimiento de consultas
-
Informe de visita
-
Informe de visita de seguimiento
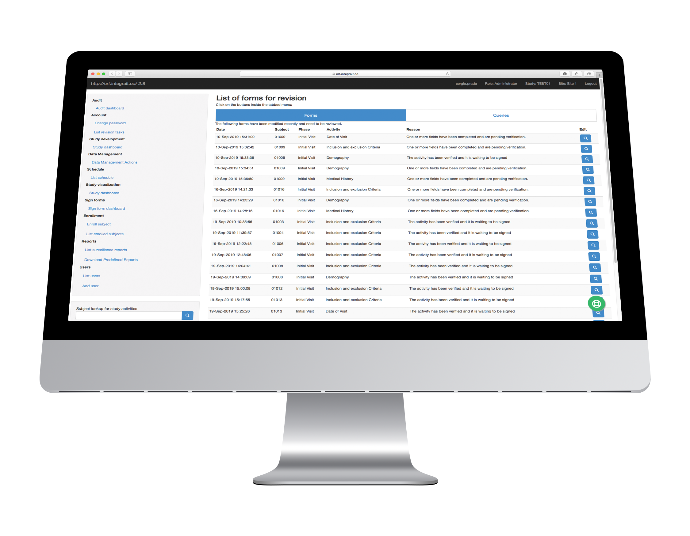
Informes Predefinidos
Los administradores también pueden crear informes con información personalizada obtenida de las bases de datos para consultas particulares. Estos informes se pueden configurar al principio o durante la Prueba según se requiera y sin costo adicional.






